 Rivista in lingua italiana
Rivista in lingua italiana
riservata ai Soci SISA
Ultimo numero:
Anno 16 • N.1/2025
SISANews
Effetto nocebo: che cosa possiamo imparare dallo studio ASCOT-LLA?
Questo articolo è una successiva analisi dello studio ASCOTT-LLA, analisi che ha avuto lo scopo di valutare il così detto effetto nocebo, cioè se essere consapevoli di che cosa si sta assumendo può indurre al rilievo di un maggiore numero di effetti collaterali. ASCOTT-LLA è un trial randomizzato in doppio cieco che è stato fatto dal 1998 al 2002. Lo studio aveva confrontato l'efficacia in prevenzione primaria di atorvastatina 10 mg contro placebo in pazienti in terapia antiipertensiva ad alto rischio cardiovascolare. Lo studio è stato interrotto prematuramente per dimostrata superiore efficacia nei pazienti in trattamento con atorvastatina. I pazienti sono stati successivamente seguiti fino al 2005 in uno studio aperto. Durante il periodo in cieco disturbi di tipo muscolare nei pazienti in terapia sono stati del 2,03% per anno contro il 2,0% per anno dei soggetti in placebo, quindi senza una differenza significativa.
Al contrario nel successivo periodo di follow-up durante il quale i pazienti hanno incominciato o continuato ad assumere atorvastatina sapendolo, il numero di segnalazioni di problemi muscolari è stato significativamente più elevato nei pazienti in terapia rispetto ai pazienti senza [161 (1,26% per anno) vs 124 (1,0% per anno)], mentre sovrapponibili sono risultati altri effetti collaterali come disfunzione erettile, insonnia e decadimento cognitivo.
La conclusione degli autori è che il maggiore numero di disturbi muscolari legati all'assunzione di statine segnalati negli studi osservazionali e negli studi aperti rispetto agli studi in cieco possa essere considerato un effetto nocebo.
![]()
SCANDINAVIAN CARDIAC OUTCOMES TRIAL-LIPID-LOWERING ARM (ASCOT-LLA): A RANDOMISED DOUBLE-BLIND PLACEBO-CONTROLLED TRIAL AND ITS NON-RANDOMISED NON-BLIND EXTENSION PHASE
Gupta A, Thompson D, Whitehouse A, Collier T, Dahlof B, Poulter N, Collins R, Sever P; ASCOT Investigators
Lancet 2017; 389:2473-2481
BACKGROUND: in blinded randomised controlled trials, statin therapy has been associated with few adverse events (AEs). By contrast, in observational studies, larger increases in many different AEs have been reported than in blinded trials.
METHODS: in the Lipid-Lowering Arm of the Anglo-Scandinavian Cardiac Outcomes Trial, patients aged 40-79 years with hypertension, at least three other cardiovascular risk factors, and fasting total cholesterol concentrations of 6·5 mmol/L or lower, and who were not taking a statin or fibrate, had no history of myocardial infarction, and were not being treated for angina were randomly assigned to atorvastatin 10 mg daily or matching placebo in a randomised double-blind placebo-controlled phase. In a subsequent non-randomised non-blind extension phase (initiated because of early termination of the trial because efficacy of atorvastatin was shown), all patients were offered atorvastatin 10 mg daily open label. We classified AEs using the Medical Dictionary for Regulatory Activities. We blindly adjudicated all reports of four prespecified AEs of interest-muscle-related, erectile dysfunction, sleep disturbance, and cognitive impairment-and analysed all remaining AEs grouped by system organ class. Rates of AEs are given as percentages per annum.
RESULTS: the blinded randomised phase was done between February, 1998, and December, 2002; we included 101?80 patients in this analysis (5101 [50%] in the atorvastatin group and 5079 [50%] in the placebo group), with a median follow-up of 3·3 years (IQR 2·7-3·7). The non-blinded non-randomised phase was done between December, 2002, and June, 2005; we included 9899 patients in this analysis (6409 [65%] atorvastatin users and 3490 [35%] non-users), with a median follow-up of 2·3 years (2·2-2·4). During the blinded phase, muscle-related AEs (298 [2·03% per annum] vs 283 [2·00% per annum]; hazard ratio 1·03 [95% CI 0·88-1·21]; p=0·72) and erectile dysfunction (272 [1·86% per annum] vs 302 [2·14% per annum]; 0·88 [0·75-1·04]; p=0·13) were reported at a similar rate by participants randomly assigned to atorvastatin or placebo. The rate of reports of sleep disturbance was significantly lower among participants assigned atorvastatin than assigned placebo (149 [1·00% per annum] vs 210 [1·46% per annum]; 0·69 [0·56-0·85]; p=0·0005). Too few cases of cognitive impairment were reported for a statistically reliable analysis (31 [0·20% per annum] vs 32 [0·22% per annum]; 0·94 [0·57-1·54]; p=0·81). We observed no significant differences in the rates of all other reported AEs, with the exception of an excess of renal and urinary AEs among patients assigned atorvastatin (481 [1·87%] per annum vs 392 [1·51%] per annum; 1·23 [1·08-1·41]; p=0·002). By contrast, during the non-blinded non-randomised phase, muscle-related AEs were reported at a significantly higher rate by participants taking statins than by those who were not (161 [1·26% per annum] vs 124 [1·00% per annum]; 1·41 [1·10-1·79]; p=0·006). We noted no significant differences between statin users and non-users in the rates of other AEs, with the exception of musculoskeletal and connective tissue disorders (992 [8·69% per annum] vs 831 [7·45% per annum]; 1·17 [1·06-1·29]; p=0·001) and blood and lymphatic system disorders (114 [0·88% per annum] vs 80 [0·64% per annum]; 1·40 [1·04-1·88]; p=0·03), which were reported more commonly by statin users than by non-users.
INTERPRETATION: these analyses illustrate the so-called nocebo effect, with an excess rate of muscle-related AE reports only when patients and their doctors were aware that statin therapy was being used and not when its use was blinded. These results will help assure both physicians and patients that most AEs associated with statins are not causally related to use of the drug and should help counter the adverse effect on public health of exaggerated claims about statin-related side-effects.
FUNDING: Pfizer, Servier Research Group, and Leo Laboratories.
Area Soci
Eventi
39° Congresso Nazionale
 39° Congresso Nazionale
39° Congresso NazionaleRoma, 23-25 novembre 2025
Save the date




 Spring Meeting Gruppi Giovani SID, SIGG, SIIA, SIMI, SIPREC, SISA
Spring Meeting Gruppi Giovani SID, SIGG, SIIA, SIMI, SIPREC, SISARimini, 6-8 aprile 2025
[continua a leggere]
 SISA LIPID ACADEMY - Corso avanzato di lipidologia clinica
SISA LIPID ACADEMY - Corso avanzato di lipidologia clinicaModena, 4-5 Luglio 2024
[continua a leggere]Giornale Italiano Arteriosclerosi
HoFH today
 Rivista Italiana della
Rivista Italiana della
Ipercolesterolemia
Familiare Omozigote
Anno 6 • N.1/2024
Rivista NMCD
Diateca
[continua a leggere]
[continua a leggere]
Newsletter
il vostro indirizzo di posta elettronica
Progetto LIPIGEN
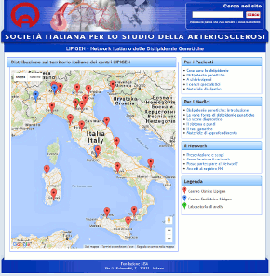
Nuovo sito dedicato al Progetto LIPIGEN
Progetto LIPIGEN - Vecchio portale
E' necessario essere loggati come utente
Lipigen per poter accedere alla pagina
PROject Statin Intolerance SISA
PROSISA – PROject Statin Intolerance SISA
E' necessario essere loggati come utente
PROSISA per poter accedere alla pagina
GILA - Lipoprotein Aferesi
Gruppo Interdisciplinare Lipoprotein Aferesi
(Accesso Gruppo GILA-Lipoprotein Aferesi)
E' necessario essere loggati come utente del Gruppo GILA per poter accedere
Gruppo Interdisciplinare Lipoprotein Aferesi
(Documentazione ad accesso libero)
Pagina informativa per medici e pazienti










