 Rivista in lingua italiana
Rivista in lingua italiana
riservata ai Soci SISA
Ultimo numero:
Anno 16 • N.1/2025
Novità
Notizie dal 32° Congresso Nazionale SISA - 26 novembre - Parte 2
Alirocumab, ipercolesterolemia e sindrome coronarica acuta
CTT ha dimostrato che una riduzione più aggressiva dei livelli di LDL-C riduce gli eventi cardiovascolari del 40-50%, e si osserva una riduzione del 22% per mmol/l di riduzione dei livelli di LDL-C. Quanto e come diminuire LDL-C? Con una riduzione del 50% dei livelli di LDL-C si blocca la progressione della placca. Questo si può ottenere aggiungendo alle statine ezetimibe o mAbs anti-PCSK9. Lo studio IMPROVE-IT ha mostrato che l’associazione simvastatina+ezetimibe riduce LDL-C ed eventi cardiovascolari più della simvastatina da sola senza problemi di sicurezza. I risultati dello studio ODYSSEY Outcomes ha mostrato che, in soggetti post-ACS con elevati livelli di lipoproteine aterogene nonostante ottimale terapia ipocolesterolemizzante, l’aggiunta di alirocumab riduce l’endpoint primario del 15%, con riduzioni significative anche degli endpoint secondari. L’effettiva di protezione è particolarmente evidente in soggetti con LDL-C basali >100 mg/dl. Alirocumab riduce la mortalità in pazienti con recente ACS in follow-up superiore ai 3 anni, indicando che un trattamento più lungo evidenzia un effetto positivo maggiore. C’è un effetto positivo anche su mortalità per tutte le cause e cardiovascolare in pazienti con valori basali di LDL-C >100 mg/dL, ma non per cause non-cardiovascolari (che però non era outcome prespecificato), anche se le due curve (trattati e placebo) tendono a divergere. Infine, alirocumab riduce eventi cardiovascolari totali non fatali e fatali.
Livelli estremi di LDL: dalla genetica alle terapie innovative
Ipercolesterolemia severa può essere determinata sia da un concetto di severità assoluta (LDL-C>190 mg/dl) sia da un concetto di severità relativa (legata prevalentemente a un profilo lipidico alterato). All’interno di questa definizione rientrano sia i soggetti con FH monogenica definita, sia soggetti con FH poligenica, ma comprende anche soggetti la cui causa genetica non è definita. I soggetti con FH monogenica hanno diverse opzioni di trattamento, tra cui statine, a cui aggiungere ezetimibe ed eventualmente aferesi (questi trattamenti sono applicabili anche ai bambini); per gli adulti è prevista anche la possibilità di utilizzare lomitapide e nei casi più gravi il trapianto di fegato. Lomitapide aumenta la percentuale di coloro che raggiungono target e riduce la necessità di aferesi. Evolocumab o alirocumab sono indicati pazienti eterozigoti o omozigoti difettivi.
Diverse varianti geniche comuni sono associate a piccole riduzioni dei livelli di LDL-C, mentre altre varianti più rare hanno effetto più marcato sui livelli di LDL-C. Tra i geni coinvolti ci sono apoB, PCSK9, ANGPTL3 e NPC1L1. Alcune mutazioni del gene per apoB, che risultano in una proteina troncata priva di funzione, determinano FHBL1, caratterizzata da ridotti livelli di LDL-C; tuttavia mancano sia studi di associazione di queste varianti con il rischio cardiovascolare sia studi di randomizzazione mendeliana. Un solo studio ha riportato, in portatori di mutazioni su apoB, stessi valori di IMT rispetto a soggetti normali, ma con una stifness carotidea inferiore. Esistono varianti geniche di PCSK9 che determinano FHBL1, caratterizzato da maggiore espressione di LDLR epatico. L’analisi di 4 varianti che risultano in una proteina tronca priva di funzione, ha evidenziato una riduzione dei livelli di LDL-C del 28%, che si traduce in una riduzione dell’incidenza di eventi cardiovascolari pari a 88% durante i 15 anni di follow-up. R46L è una mutazione missnso mediamente rara che determina riduzione di LDL-C pari a 15% e riduzione del 47% dell’incidenza di eventi cardiovascolari. Anche l’IMT risulta ridotto.
Varianti loss-of-function di ANGPTL3 sono associate a ipolipidemia familiare combinata (FHBL2), caratterizzata da riduzioni di TG, LDL-C, apoB. Portatori eterozigoti mostrano riduzione dei livelli di LDL-C del 9%, gli omozigoti del 67%. Carenza genetica di ANGPTL3 è protettiva ed è associata a riduzione significativa del rischio cardiovascolare.
Gli effetti che si possono ottenere riducendo molto i livelli di LDL-C possono essere classificati in 4 gruppi: 1) steatosi epatica, che si può avere bloccando la sintesi di colesterolo con statine o l’assemblaggio delle lipoproteine con lomitapide o mipomersen. GLI studi FOURIER e ODYSSEY OUTCOMES non ha mostrato evidenze di aumento di transaminasi con mAbs anti-PCSK9. 2) insorgenza di diabete. Le statine hanno effetto diabetogenico, mentre non sembra esserci questo effetto con mAbs anti-PCSK9. 3) Demenza e psicosi. Le statine non solo non inducono demenza, ma addirittura il rischio di demenza nell’uomo sembra essere ridotto all’aumentare del tempo di terapia. I mAbs anti-PCSK9 non hanno nessun effetto. 4) Ormoni e vitamine. I mAbs anti-pcsk9 non hanno effetto su cortisolo ma riducono vitamina E, probabilmente a causa della riduzione delle LDL che trasportano questa vitamina. La carenza di vitamina E può indurre effetti neurologici negativi quando <3 µg/ml, ma nei trials con mAbs i livelli sono 60 µg/ml. 15 mg/dL è il valore più basso osservato con mutazioni PCSK9 in soggetti asintomatici; forse questo può essere, per le conoscenze attuali, considerato il valore limite.
Rischio cardiovascolare nei pazienti con disturbi del sonno?
Il sonno ha effetto sulle funzioni cardiovascolari, e alterazioni cardiorespiratorie durante il sonno sono frequenti nella malattia cardiaca. Il sonno è formato da cicli che si ripetono, e la fase REM sembra essere la più importante per gli eventi cardiovascolari. La deprivazione del sonno o la mancanza cronica di sonno hanno diversi effetti negativi, tra cui aumento della pressione. Metanalisi hanno mostrato aumento di patologie cardio- o cerebro-vascolari legati a disturbi del sonno. Sonno breve combinato a sonno di cattiva qualità aumenta notevolmente l’incidenza di mortalità cardiovascolare. Una durata ridotta del sonno aumenta stress ossidativo e la produzione di citochine infiammatorie. Il trattamento dell’insonnia nel pax ipertesto, prevede l’uso di diversi farmaci tra cui benzodiazepine, che però hanno molti effetti collaterali, o gli agonisti dei recettori della melatonina, in grado di ripristinare la riduzione di pressione fisiologica notturna. Altro aspetto rilevante sono le apnee del sonno, che se ripetute nel tempo determinano desaturazione di ossigeno con variazioni della pressione che tende ad aumentare. All’aumentare della frequenza delle apnee aumenta l’incidenza di ipertensione. L’apnea notturna determina anche aumento dell’incidenza di fibrillazione atriale e aumenta la morte improvvisa, così come lo scompenso. Le apnee notturne vengono trattate con CPAP, che però non è l’unica opzione. La CPAP riduce la pressione, ma le metanalisi non evidenziano riduzioni significative, forse perché si comincia il trattamento quando ormai è presente danno d’organo o altre morbidità.
Area Soci
Eventi
39° Congresso Nazionale
 39° Congresso Nazionale
39° Congresso NazionaleRoma, 23-25 novembre 2025
Save the date




 Spring Meeting Gruppi Giovani SID, SIGG, SIIA, SIMI, SIPREC, SISA
Spring Meeting Gruppi Giovani SID, SIGG, SIIA, SIMI, SIPREC, SISARimini, 6-8 aprile 2025
[continua a leggere]
 SISA LIPID ACADEMY - Corso avanzato di lipidologia clinica
SISA LIPID ACADEMY - Corso avanzato di lipidologia clinicaModena, 4-5 Luglio 2024
[continua a leggere]Giornale Italiano Arteriosclerosi
HoFH today
 Rivista Italiana della
Rivista Italiana della
Ipercolesterolemia
Familiare Omozigote
Anno 6 • N.1/2024
Rivista NMCD
Diateca
[continua a leggere]
[continua a leggere]
Newsletter
il vostro indirizzo di posta elettronica
Progetto LIPIGEN
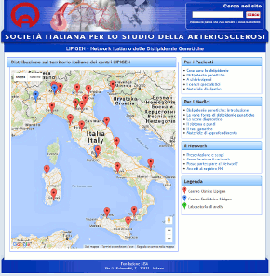
Nuovo sito dedicato al Progetto LIPIGEN
Progetto LIPIGEN - Vecchio portale
E' necessario essere loggati come utente
Lipigen per poter accedere alla pagina
PROject Statin Intolerance SISA
PROSISA – PROject Statin Intolerance SISA
E' necessario essere loggati come utente
PROSISA per poter accedere alla pagina
GILA - Lipoprotein Aferesi
Gruppo Interdisciplinare Lipoprotein Aferesi
(Accesso Gruppo GILA-Lipoprotein Aferesi)
E' necessario essere loggati come utente del Gruppo GILA per poter accedere
Gruppo Interdisciplinare Lipoprotein Aferesi
(Documentazione ad accesso libero)
Pagina informativa per medici e pazienti










