 Rivista in lingua italiana
Rivista in lingua italiana
riservata ai Soci SISA
Ultimo numero:
Anno 16 • N.1/2025
SISANews
PCSK9 non regola solo la colesterolemia
L'azione più nota di PCSK9 è il suo coinvolgimento nella regolazione della colesterolemia. L'enzima agisce principalmente nel fegato degradando i recettori per le LDL e, in alcune situazioni genetiche caratterizzate da un guadagno di funzione, è responsabile di ipercolesterolemia. La sua produzione è regolata a livello trascrizionale da steroidi, insulina, glucagone, etinilestradiolo e anche dal digiuno. Viene prodotto dal fegato ed attraverso il circolo raggiunge altri organi e tessuti, tra i quali il tessuto adiposo. Proprio nel tessuto adiposo svolge un'altra funzione regolatoria del metabolismo dei grassi e cioè la degradazione dei recettori di superficie per le VLDL. Se i recettori non vengono degradati, le VLDL continuano ad essere internalizzate negli adipociti che aumentano così il proprio contenuto in grassi. Ed è proprio questo che è stato osservato in topi deficienti di PCSK9. Manca ancora la dimostrazione che il sistema funzioni anche nell'uomo. Si sa già che i recettori VLDL nell'uomo sono degradati dal PCSK9, adesso bisogna dimostrare che la deficienza dell'enzima comporti nell'uomo, come nell'animale da esperimento, un abnorme accumulo di grasso nel tessuto adiposo.
![]()
Circulating proprotein convertase subtilisin/kexin 9 (PCSK9) regulates VLDLR protein and triglyceride accumulation in visceral adipose tissue
Roubtsova A, Munkonda MN, Awan Z, Marcinkiewicz J, Chamberland A, Lazure C, Cianflone K, Seidah NG, Prat A.
Arterioscler Thromb Vasc Biol 2011;31:785-791
OBJECTIVE: Proprotein convertase subtilisin/kexin 9 (PCSK9) promotes the degradation of the low-density lipoprotein receptor (LDLR), and its gene is the third locus implicated in familial hypercholesterolemia. Herein, we investigated the role of PCSK9 in adipose tissue metabolism.
METHODS AND RESULTS: At 6 months of age, Pcsk9(-/-) mice accumulated ˜80% more visceral adipose tissue than wild-type mice. This was associated with adipocyte hypertrophy and increased in vivo fatty acid uptake and ex vivo triglyceride synthesis. Moreover, adipocyte hypertrophy was also observed in Pcsk9(-/-) Ldlr(-/-) mice, indicating that the LDLR is not implicated. Rather, we show here by immunohistochemistry that Pcsk9(-/-) males and females exhibit 4- and ˜ 40-fold higher cell surface levels of very-low-density lipoprotein receptor (VLDLR) in perigonadal depots, respectively. Expression of PCSK9 in the liver of Pcsk9(-/-) females reestablished both circulating PCSK9 and normal VLDLR levels. In contrast, specific inactivation of PCSK9 in the liver of wild-type females led to ˜ 50-fold higher levels of perigonadal VLDLR.
CONCLUSIONS: In vivo, endogenous PCSK9 regulates VLDLR protein levels in adipose tissue. This regulation is achieved by circulating PCSK9 that originates entirely in the liver. PCSK9 is thus pivotal in fat metabolism: it maintains high circulating cholesterol levels via hepatic LDLR degradation, but it also limits visceral adipogenesis likely via adipose VLDLR statins.
Arterioscler Thromb Vasc Biol 2011;31:785-791
Area Soci
Eventi
39° Congresso Nazionale
 39° Congresso Nazionale
39° Congresso NazionaleRoma, 23-25 novembre 2025
Save the date




 Spring Meeting Gruppi Giovani SID, SIGG, SIIA, SIMI, SIPREC, SISA
Spring Meeting Gruppi Giovani SID, SIGG, SIIA, SIMI, SIPREC, SISARimini, 6-8 aprile 2025
[continua a leggere]
 SISA LIPID ACADEMY - Corso avanzato di lipidologia clinica
SISA LIPID ACADEMY - Corso avanzato di lipidologia clinicaModena, 4-5 Luglio 2024
[continua a leggere]Giornale Italiano Arteriosclerosi
HoFH today
 Rivista Italiana della
Rivista Italiana della
Ipercolesterolemia
Familiare Omozigote
Anno 6 • N.1/2024
Rivista NMCD
Diateca
[continua a leggere]
[continua a leggere]
Newsletter
il vostro indirizzo di posta elettronica
Progetto LIPIGEN
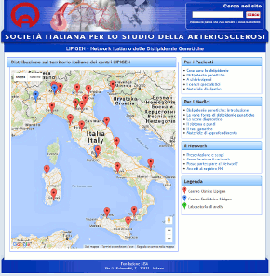
Nuovo sito dedicato al Progetto LIPIGEN
Progetto LIPIGEN - Vecchio portale
E' necessario essere loggati come utente
Lipigen per poter accedere alla pagina
PROject Statin Intolerance SISA
PROSISA – PROject Statin Intolerance SISA
E' necessario essere loggati come utente
PROSISA per poter accedere alla pagina
GILA - Lipoprotein Aferesi
Gruppo Interdisciplinare Lipoprotein Aferesi
(Accesso Gruppo GILA-Lipoprotein Aferesi)
E' necessario essere loggati come utente del Gruppo GILA per poter accedere
Gruppo Interdisciplinare Lipoprotein Aferesi
(Documentazione ad accesso libero)
Pagina informativa per medici e pazienti










