 Rivista in lingua italiana
Rivista in lingua italiana
riservata ai Soci SISA
Ultimo numero:
Anno 16 • N.1/2025
Novità
La commissione europea approva Kanuma (sebelipasi alfa)
1 settembre 2015 - la Commissione Europea ha approvato Kanuma (sebelipasi alfa), con indicazione per la terapia enzimatica sostitutiva a lungo termine (long-term enzyme replacement therapy, ERT) nei pazienti di tutte le età affetti da deficit della lipasi acida lisosomiale (LAL-D). Kanuma, una nuova ERT, è il primo trattamento approvato nell'Unione Europea per pazienti affetti da questa patologia. La decisione segue il parere positivo espresso dal Comitato per i medicinali per uso umano (CHMP) nello scorso giugno.
La LAL-D è una malattia metabolica genetica estremamente rara (interessa meno di 20 su un milione di persone), cronica e progressiva, associata a rilevante morbilità e mortalità precoce. Nei pazienti affetti da LAL-D, le mutazioni genetiche portano a riduzione o perdita dell'attività dell'enzima LAL, con conseguente notevole accumulo di trigliceridi ed esteri del colesterolo, che risulta in danni progressivi e multisistemici, compresi fibrosi, cirrosi, insufficienza epatica, aterosclerosi accelerata e malattie cardiovascolari.
La sebelipasi alfa, prodotto dell'ingegneria genetica, è la forma sintetica dell'enzima mancante nel deficit della lipasi acida lisosomiale. L'approvazione di Kanuma nell'UE si è basata su dati provenienti da due studi clinici e uno studio di estensione in aperto comprendente pazienti in età neonatale, pediatrica e adulta affetti da LAL-D. I risultati hanno mostrato vantaggi notevoli in termini di sopravvivenza oltre 12 mesi (67%) nei pazienti affetti da forma neonatale di LAL-D, rispetto a 0% su pazienti in una coorte storica non trattata. Nei pazienti pediatrici e adulti, il trattamento ha portato alla normalizzazione della ALT, alla riduzione del contenuto di lipidi nel fegato e altri marcatori di danni epatici rispetto al placebo, oltre a notevole miglioramento degli accumuli lipidici. In pazienti che hanno ricevuto Kanuma durante il periodo in doppio cieco e successivamente sono entrati nel periodo di estensione in aperto, le riduzioni nei livelli di ALT sono state mantenute e si sono verificati ulteriori miglioramenti nei livelli di colesterolo LDL e HDL.
Le reazioni avverse più gravi riscontrate nel corso degli studi clinici sono state segni e sintomi compatibili con l'anafilassi, come dolore toracico, arrossamento degli occhi, dispnea, rash generalizzato con prurito, iperemia, leggero edema palpebrale, rinorrea, gravi problemi respiratori, tachicardia, tachipnea e orticaria.
Area Soci
Eventi
39° Congresso Nazionale
 39° Congresso Nazionale
39° Congresso NazionaleRoma, 23-25 novembre 2025
Save the date




 Spring Meeting Gruppi Giovani SID, SIGG, SIIA, SIMI, SIPREC, SISA
Spring Meeting Gruppi Giovani SID, SIGG, SIIA, SIMI, SIPREC, SISARimini, 6-8 aprile 2025
[continua a leggere]
 SISA LIPID ACADEMY - Corso avanzato di lipidologia clinica
SISA LIPID ACADEMY - Corso avanzato di lipidologia clinicaModena, 4-5 Luglio 2024
[continua a leggere]Giornale Italiano Arteriosclerosi
HoFH today
 Rivista Italiana della
Rivista Italiana della
Ipercolesterolemia
Familiare Omozigote
Anno 6 • N.1/2024
Rivista NMCD
Diateca
[continua a leggere]
[continua a leggere]
Newsletter
il vostro indirizzo di posta elettronica
Progetto LIPIGEN
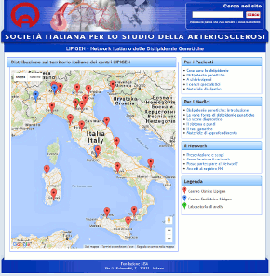
Nuovo sito dedicato al Progetto LIPIGEN
Progetto LIPIGEN - Vecchio portale
E' necessario essere loggati come utente
Lipigen per poter accedere alla pagina
PROject Statin Intolerance SISA
PROSISA – PROject Statin Intolerance SISA
E' necessario essere loggati come utente
PROSISA per poter accedere alla pagina
GILA - Lipoprotein Aferesi
Gruppo Interdisciplinare Lipoprotein Aferesi
(Accesso Gruppo GILA-Lipoprotein Aferesi)
E' necessario essere loggati come utente del Gruppo GILA per poter accedere
Gruppo Interdisciplinare Lipoprotein Aferesi
(Documentazione ad accesso libero)
Pagina informativa per medici e pazienti










